AG Prof. Volk
Kardiale Ionenkanäle
Der Forschungsschwerpunkt der Professur für Herz-Kreislaufphysiologie ist die Pathophysiologie von Herzrhythmusstörungen (Arrhythmien) und von Kontraktionsschwäche bei Herzversagen (Herzinsuffizienz). Herzinsuffizienz führt zu strukturellen und regulativen Veränderungen sowohl auf makroskopischer als auch auf mikroskopischer und molekularer Ebene. Diese Prozesse werden als „Remodelling“ bezeichnet und stören die elektromechanische Funktion des Herzens. So kann beispielsweise eine gestörte Regulation oder Expression kardialer Ionenkanäle zu Herzrhythmusstörungen bis hin zum plötzlichen Herztod führen. Eine übermäßige Produktion von Bindegewebe (Fibrose) oder ein Umbau der Zellstruktur können die Kontraktionskraft des Herzens beeinträchtigen und die Herzinsuffizienz verschlimmern. Unser Ziel ist es, die zellulären Mechanismen, die zu diesem Remodelling führen, besser zu verstehen, um daraus neue diagnostische, therapeutische oder präventive Ansätze abzuleiten. Wir arbeiten eng mit Kolleginnen und Kollegen aus der Herzchirurgischen Klinik und Kinderkardiologischen Abteilung zusammen, was uns translationale Forschungsprojekte ermöglicht.
Zelluläre kardiale Elektrophysiologie
Um die Funktion und Regulation von Ionenkanälen zu untersuchen, wird ein breites Spektrum an elektrophysiologischen, molekularbiologischen und zellphysiologischen Methoden eingesetzt. Um Ströme durch bestimmte Ionenkanäle oder Membranpotentiale zu messen, verwenden wir die Patch-Clamp-Technik, bei der einzelne Herzzellen mit einer Mikropipette elektrisch kontrolliert werden. So können u.a. Ionenströme gemessen werden, die eine wichtige Rolle bei der Entstehung von Aktionspotentialen und der Initiierung der Kontraktion haben. Es ist bekannt, dass Unterschiede in der Aktionspotentialdauer (APD) in verschiedenen Regionen des Herzens für eine normale Erregungsrückbildung von großer Wichtigkeit sind. So besteht über die freie Wand des linken Ventrikels ein Gradient in der APD mit einer deutlich größeren APD in endokardnahen als in epikardnahen Schichten. Dies führt dazu, dass endokardnahe Schichten, obwohl sie zuerst erregt werden, erst im Anschluss an epikardnahe Schichten repolarisieren. Die Erregung breitet sich also vom Endokard zum Epikard hin aus, bildet sich aber vom Epikard zum Endokard hin zurück. Dieser wohlorganisierte Ablauf der Erholung von der Erregung ist unter pathologischen Bedingungen, wie beispielsweise einer Herzhypertrophie oder Herzinsuffizienz, empfindlich gestört, was bei diesen Patienten zu einem erhöhten Risiko für Herzrhythmusstörungen und plötzlichen Herztod beiträgt.
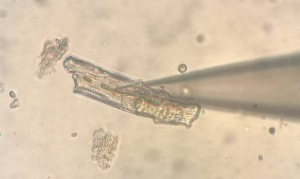
Um die zugrundeliegenden Mechanismen besser zu verstehen, werden in der Arbeitsgruppe an Tier- und Zellkulturmodellen experimentell die an der Steuerung der kardialen Erregungsbildung und -rückbildung beteiligten Ionenkanäle (u. a. Na+, K+ und Ca2+-Kanäle), ihre Regulation und Pharmakologie untersucht. Im Vordergrund steht dabei die Identifikation von Signalkaskaden, die an der Regulation dieser Ionenkanäle unter pathophysiologischen Bedingungen beteiligt sind. So liegt ein Schwerpunkt der Arbeitsgruppe in der Aufklärung der Rolle des kardialen Mineralokortikoidrezeptors (MR) bei der Regulation kardialer Ca2+ und K+ Kanäle. Ziel der Untersuchung kardialer Ionenkanäle ist es, durch ein tieferes Verständnis der Mechanismen kardialer Erregungsrückbildung in Zukunft die Möglichkeit zu erhalten, spezifisch in die Organisation der Repolarisation eingreifen und so der Entstehung von Herzrhythmusstörungen vorbeugen zu können.
Elektromechanische Kopplung
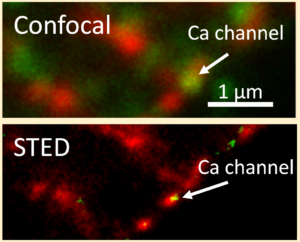
Elektromechanische Kopplung ist der Prozess, der elektrische Signale an der Herzmuskelzelle, d. h. Aktionspotentiale, in eine mechanische Aktion, d. h. Kontraktion, überführt. Im Herzen geschieht dies durch einen Einstrom von Kalziumionen durch den LTyp-Ca2+-Kanal in die Zelle, welche dann an Ryanodin-Rezeptoren im sarkoplasmatischen Retikulum binden und dadurch eine zusätzliche Kalziumfreisetzung aus intrazellulären Speichern bewirken. Dies nennt man daher auch Ca2+-induzierte Ca2+-Freisetzung. Die resultierende Zunahme der intrazellulären Ca2+-Konzentration bewirkt dann die Kontraktion. Dabei ist es wichtig, wieviel Ca2+ freigesetzt wird und wie schnell dies geschieht. Wird zu wenig Ca2+ freigesetzt oder dauert die Freisetzung zu lange, dann wird die Kontraktion ineffizient und schwach. Und eben dies geschieht bei Herzinsuffizienz, ausgelöst unter anderem durch einen Umbau der mikroskopischen Struktur von Herzmuskelzellen.
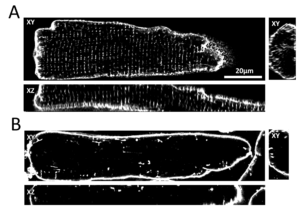
Das transversale tubuläre System (T-System) in ventrikulären Kardiomyozyten besteht aus vielen schlauchförmigen Membraneinstülpungen, die von außen in das Zellinnere verlaufen. Ca2+-Kanäle sind bevorzugt in der Membran dieser T-Tubuli lokalisiert und stehen in engem Kontakt zu den Ryanodinrezeptoren. Die Aufgabe der T-Tubuli ist es also, möglichst viele Ca2+-Kanäle sehr nah an Ryanodinrezeptoren heranzuführen, damit die Ca2+-induzierte Ca2+-Freisetzung effizient und schnell ablaufen kann. Bei Herzinsuffizienz ist die Struktur des T-Systems und damit auch die Lokalisation der Ca2+-Kanäle gestört, was durch hochauflösende dreidimensionale Mikroskopie (konfokale oder STED Mikroskopie) sichtbar gemacht werden kann. Folge davon ist eine verzögerte und unregelmäßige Ca2+-Freisetzung, die mit Hilfe von Ca2+-Indikatoren untersucht und mit computergestützter Bildverarbeitung quantifiziert werden kann. In Zell- und Gewebekulturmodellen sowie an menschlichen Zellen und Geweben untersuchen wir, welche zellulären Prozesse und Signale T-System-Veränderungen bewirken und wie diese Prozesse aufgehalten oder rückgängig gemacht werden können. Außerdem korrelieren wir die strukturellen und funktionellen Veränderungen mit dem klinischen Erscheinungsbild von Patienten, um mögliche prognostische oder diagnostische Zusammenhänge zu erkennen und ggf. neue Therapiestrategien entwickeln zu können.