AG Prof. Korbmacher
Mitglied des Transregio (SFB) TRR374
Teilprojekt A4: Tubular and interstitial proteases as regulators of the epithelial sodium channel (ENaC).
Renale epitheliale Ionenkanäle
Publikationen Christoph Korbmacher
Der Forschungsschwerpunkt der Arbeitsgruppe von Prof. Dr. C. Korbmacher ist die Physiologie und Pathophysiologie renaler und epithelialer Ionenkanäle. In der Niere und in anderen epithelialen Organen sind Ionenkanäle an der Vermittlung des hochselektiven und regulierten transepithelialen Ionentransports beteiligt. Die Erforschung dieser Ionenkanäle und ihrer Regulation ist von physiologischer und pathophysiologischer Relevanz, da eine gestörte Funktion renaler Ionenkanäle beispielsweise zu arteriellem Bluthochdruck, renalen Salzverlustsyndromen oder
polyzystischer Nierenerkrankung führen kann.
Renale Natrium- und Kaliumhomöostase Natrium- und Kaliumhomöostase
sind eng miteinander verbunden und lebenswichtig für den menschlichen Organismus. Die homöostatische Regulation hängt vor allem von der Fähigkeit der Niere ab, die renale Natrium- und Kaliumausscheidung der Natrium- und Kaliumaufnahme mit der Nahrung anzupassen. Eine ausgeglichene Natriumbilanz ist essentiell für die Aufrechterhaltung des extrazellulären Flüssigkeitsvolumens und des Blutdrucks. Eine übermäßige Natriumretention verursacht eine Expansion des extrazellulären Flüssigkeitsvolumens und kann zu Bluthochdruck und Ödemen führen. Umgekehrt führt ein renaler Natriumverlust zu einer Verarmung des extrazellulären Flüssigkeitsvolumens, was zu einer Abnahme des Blutdrucks bis hin zum Kreislaufkollaps führen kann. Die Aufrechterhaltung der Kaliumhomöostase ist für viele zelluläre Funktionen von kritischer Bedeutung, beispielsweise für die Erregbarkeit von Nerven- und Muskelzellen. Eine renale Kaliumretention oder renale Kaliumverluste können zu einer Hyperkaliämie beziehungsweise Hypokaliämie führen und dadurch Herzrhythmusstörungen oder sogar einen Herzstillstand verursachen. Pathophysiologische Störungen der renalen Natrium- oder Kaliumhomöostase können also lebensbedrohliche Symptome hervorrufen. Daher ist es von großem Interesse, die Funktion und Regulation von Ionenkanälen zu verstehen, die an der renalen Natrium- und Kaliumhomöostase beteiligt sind.
Epithelialer Natriumkanal (ENaC)
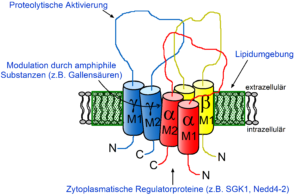
drei Untereinheiten (α, β, γ) aufgebauten epithelialen
Natriumkanals (ENaC)
Ein besonderer Fokus dieser Arbeitsgruppe ist der durch Amilorid hemmbare epitheliale Natriumkanal (ENaC) und die an seiner Regulation beteiligten molekularen Mechanismen. Der Ionenfluss durch ENaC ist der entscheidende Transportschritt für den Natriumtransport im sogenannten Aldosteron-sensitiven distalen Nephron (ASDN). Die pathophysiologische Bedeutung von ENaC für die renale Natriumhomöostase und die Blutdruckregulation belegen ‘gain of function’ und ‚loss of function‘ Mutationen des Kanals, die zu einer erblichen Form der salzsensitiven arteriellen Hypertonie (Liddle-Syndrom; Pseudohyperaldosteronismus) beziehungsweise zu einem renalen Salzverlustsyndrom (PAH1; Pseudohypoaldosteronismus Typ 1) führen. Auch im respiratorischen Epithel und im distalen Kolon ist ENaC für die Natrium- und Flüssigkeitsresorption von physiologischer und pathophysiologischer Bedeutung.
Regulation von ENaC durch hormonelle und lokale Faktoren
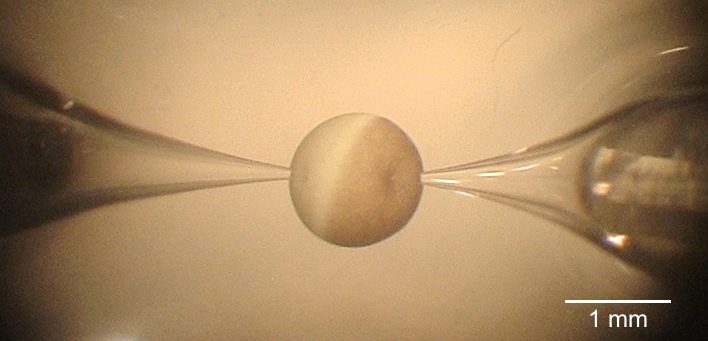
Patch von einer Xenopus laevis Oozyte mit heterologer
Expression von humanem ENaC
An der Regulation von ENaC ist ein komplexes Netzwerk hormoneller und lokaler Faktoren beteiligt. Das für die Stimulation der Kanalaktivität wichtigste Hormon ist das Aldosteron, das über den Mineralokortikoidrezeptor (MR) seine Wirkung entfaltet. Hinsichtlich regionaler Unterschiede der Aldosteronwirkung im ASDN und der an der Aldosteronwirkung beteiligten molekularen Mechanismen gibt es noch viele offene Fragen. Auch die differentielle regulatorische Wirkung von Aldosteron auf die Natriumresorption und Kaliumsekretion im ASDN ist erst ansatzweise verstanden. Im ASDN ist der sekretorische Kaliumkanal ROMK (renal outer medullary K+ channel) hauptsächlich für die Kaliumsekretion verantwortlich. Eine vermehrte ENaCAktivität fördert die Kaliumsekretion über ROMK. Dagegen führt die Hemmung von ENaC, z. B. durch Amilorid, zu einer verminderten ROMK-vermittelten Kaliumsekretion. Das regulatorische Zusammenspiel der beiden Kanäle ist daher von zentraler Bedeutung für die renale Natrium- und Kaliumhomöostase. Dabei wird die funktionelle Interaktion von ENaC und ROMK vermutlich durch eine regionale Heterogenität der Kanalregulation bedarfsgerecht justiert. Auf der zellulären und molekularen Ebene sind verschiedene Regulatorproteine (z. B. Kinasen, Proteasen und direkt mit dem Kanal assoziierte Protein) sowie die Lipidumgebung von ENaC an dessen Regulation beteiligt.
Aktivierung von ENaC durch Proteasen
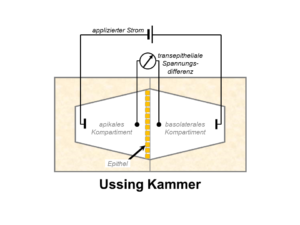
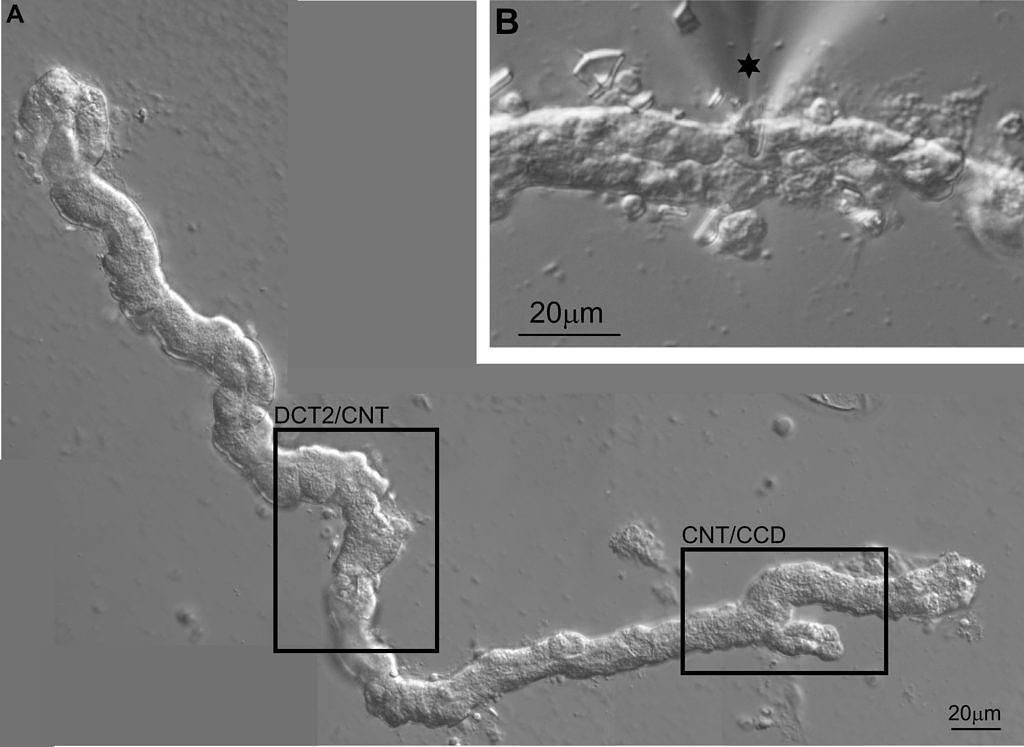
Ussing-Kammer für Kurzschlussstrommessungen zur
Quantifizierung des elektrogenen transepithelialen Ionentransports
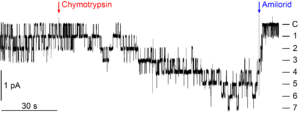
Eine spezifische Eigenschaft von ENaC ist seine Regulation durch eine komplexe proteolytische Prozessierung, die für die Kanalaktivierung entscheidend ist. Im heterologen Expresssionssystem kann diese proteolytische Kanalaktivierung eindrucksvoll nachgewiesen werden. Eine Aktivierung von ENaC durch lokal freigesetzte Proteasen könnte im Kontext von entzündlichen Nierenerkrankungen pathophysiologisch bedeutsam sein und beispielsweise beim nephrotischen Syndrom zur Natriumretention beitragen. Die an der proteolytischen Aktivierung von ENaC beteiligten molekularen Mechanismen sind allerdings erst unvollständig verstanden, und die physiologisch und pathophysiologisch relevanten Proteasen müssen noch identifiziert werden. Neben Proteasen, die ENaC durch proteolytische Spaltung spezifischer Schnittstellen direkt aktivieren, könnten interstitielle Proteasen durch eine Aktivierung basolateral lokalisierter Protease-aktivierter Rezeptoren vom Typ 2 (PAR2) den ENaC vermittelten transepithelialen Natriumtransport möglicherweise auch indirekt modulieren.
Methoden zur Untersuchung epithelialer Ionenkanäle
Um die Funktion und Regulation renaler und epithelialer Ionenkanälen zu untersuchen, werden vor allem elektrophysiologische Methoden verwendet, insbesondere transepitheliale Kurzschlussstrommessungen in Ussing-Kammern, Ganzzellstrommessungen mit der TEVC (twoelectrode voltage clamp)-Methode sowie Untersuchungen mit der Patch-Clamp-Technik, die neben Ganzzellstrommessungen auch Einzelkanalmessungen ermöglicht. Um die an der Kanalregulation beteiligten molekularen Mechanismen aufzuklären, werden außerdem verschiedene molekularbiologische und zellphysiologische Methoden eingesetzt unter Verwendung von Xenopus laevis Oozyten, kultivierten Zellen, nativem Gewebe und Tiermodellen (z. B. genetisch modifizierten Mauslinien). Darüber hinaus ermöglichen die inzwischen verfügbaren Strukturinformationen in Verbindung mit Computersimulationen und zielgerichteter Mutagenese die Untersuchung der funktionellen Bedeutung bestimmter Kanalregionen. Dieser integrative Ansatz bietet faszinierende Möglichkeiten, neue Einblicke in physiologische und pathophysiologische Mechanismen sowie ein besseres Verständnis von molekularen Krankheitsprozessen zu gewinnen.